- Labor
- Labormedizin
- IgG-Reagenz
- Neuromics
IgG-Reagenz MO22149für wissenschaftliche Forschungfür Western BlotImmunohistochimie
Zu meinen Favoriten hinzufügen
Zum Produktvergleich hinzufügen
Eigenschaften
- Typ
- IgG
- Anwendung
- für wissenschaftliche Forschung, für Western Blot, Immunohistochimie, für Immunofluoreszenz, für Immunzytochemie
- Format
- flüssig
- Getesteter Marker
- Parvalbumin
- Herkunft
- aus Mäusen gewonnen
- Lagertemperatur
Min: -20 °C
(-4 °F)Max: 4 °C
(39 °F)
Beschreibung
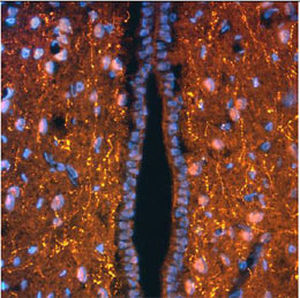
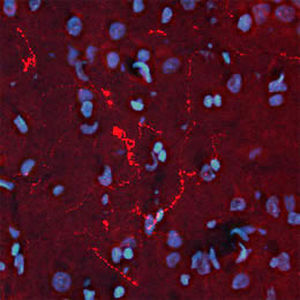
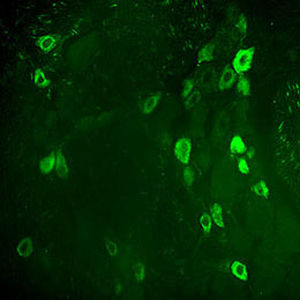
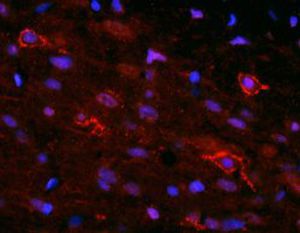
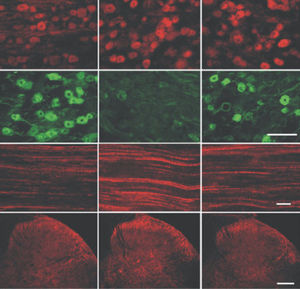
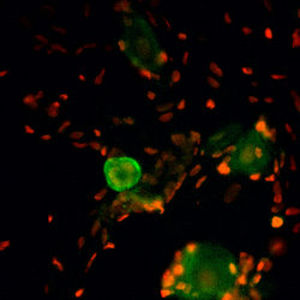
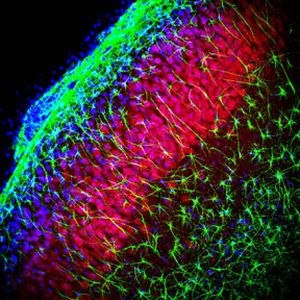
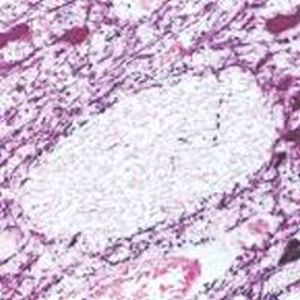
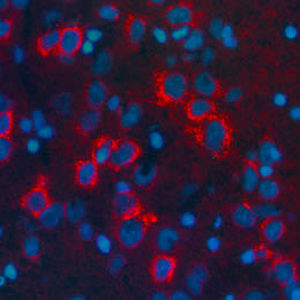
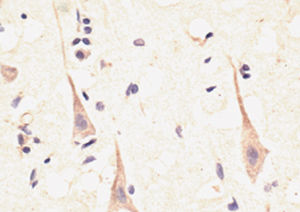
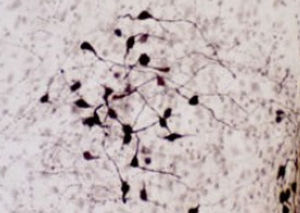
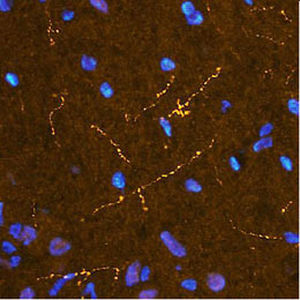
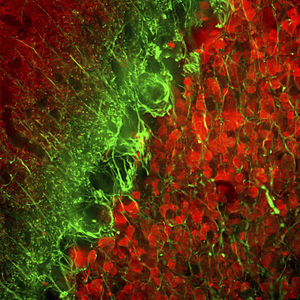
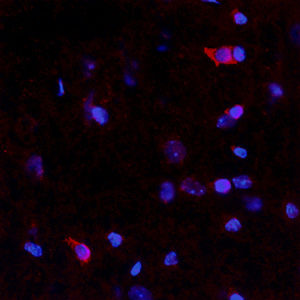
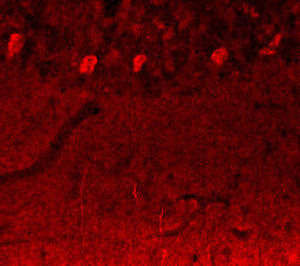
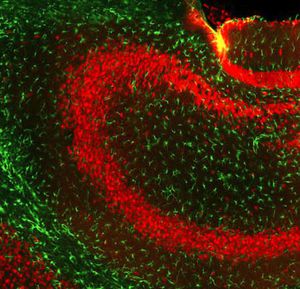
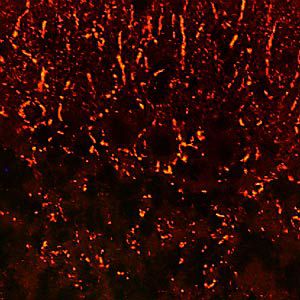
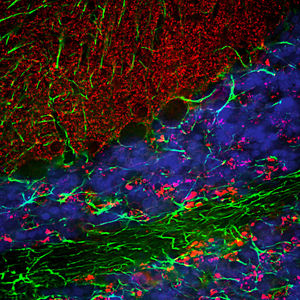
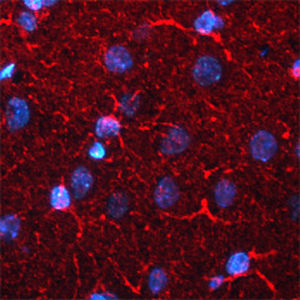
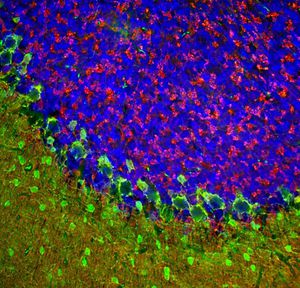
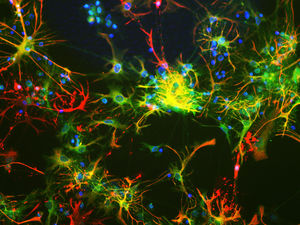
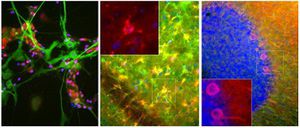
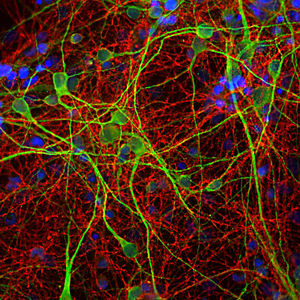
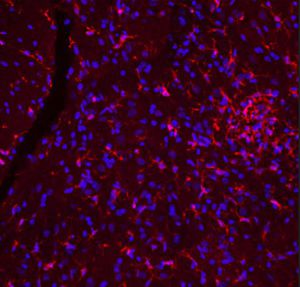
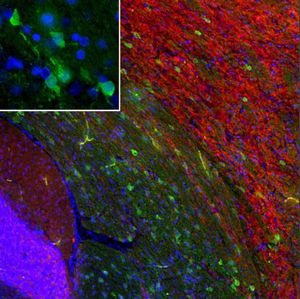
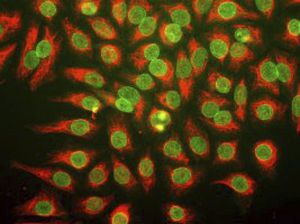
Parvalbumin ist ein zytoplasmatisches Ca2+-Bindungsprotein mit niedrigem Molekulargewicht. Es ist das prototypische Mitglied der sehr großen Familie von Proteinen mit dem Ca2+-Bindungsmotiv "EF-Hand". Die Bezeichnung stammt von der Parvalbumin-Struktur, bei der die fünfte und sechste Alpha-Helix, die E- und F-Helix, eine V-Form bilden, die saure Aminosäuren enthält, die ein einzelnes Ca2+ koordinieren. Es hat sich herausgestellt, dass enge Varianten dieser Struktur in vielen anderen Ca2+-bindenden Proteinen zu finden sind. Parvalbumin wird in schnell kontrahierenden Muskeln, wo seine Konzentration am höchsten ist, sowie im Gehirn und in einigen endokrinen Geweben exprimiert. Im Gehirn ist es vor allem in Purkinje-Zellen und Interneuronen in der Molekularschicht des Kleinhirns konzentriert, findet sich aber auch in vielen GABAergen Interneuronen im Kortex. Diese GABA-ergen Interneuronen exprimieren in den meisten Fällen nur eines von drei Ca2+-bindenden Proteinen, nämlich Parvalbumin, Calretinin oder Calbindin. Daher können diese wichtigen inhibitorischen Interneuronen anhand ihres Gehalts an diesen drei Proteinen identifiziert und unterteilt werden. Jede auf diese Weise definierte Art von Neuronen hat besondere elektrophysiologische und funktionelle Eigenschaften. Calbindin-positive Interneuronen sind zum Beispiel nicht so schnell spikend wie Parvalbumin-exprimierende Interneuronen.
---
Kataloge
Für dieses Produkt ist kein Katalog verfügbar.
Alle Kataloge von Neuromics anzeigenVerwandte Suchbegriffe
- Reagenzkit
- Reagenzkit für Molekularbiologie
- Flüssiges Reagenzkit
- Reagenzkit für Forschungszwecke
- Analysesoftware
- Protein-Reagenzkit
- Reagenz für die Immunologie
- Antikörper
- Laborsoftware
- Gefriergetrocknetes Reagenzkit
- Serum-Reagenzkit
- Immunohistochimie-Reagenzkit
- Reagenzkit für Enzyme
- Reagenzkit / monoklonaler Antikörper
- Reagenzkit für Western Blot
- Reagenz für wissenschaftliche Forschung
- Software für Forschungszwecke
- Reagenzkit für Immunofluoreszenz
- Reagenzkit / polyklonaler Antikörper
- Zytokin Reagenzkit
* Die Preise verstehen sich ohne MwSt., Versandkosten und Zollgebühren. Eventuelle Zusatzkosten für Installation oder Inbetriebnahme sind nicht enthalten. Es handelt sich um unverbindliche Preisangaben, die je nach Land, Kurs der Rohstoffe und Wechselkurs schwanken können.