- Labor
- Labormedizin
- IgG-Reagenz
- Neuromics
IgG-Reagenz MO22196für Western Blotfür Immunofluoreszenzfür Immunzytochemie
Zu meinen Favoriten hinzufügen
Zum Produktvergleich hinzufügen
Eigenschaften
- Typ
- IgG
- Anwendung
- für Western Blot, für Immunofluoreszenz, für Immunzytochemie
- Format
- flüssig
- Getesteter Marker
- PEA15
- Herkunft
- aus Mäusen gewonnen
- Lagertemperatur
Min: -20 °C
(-4 °F)Max: 4 °C
(39 °F)
Beschreibung
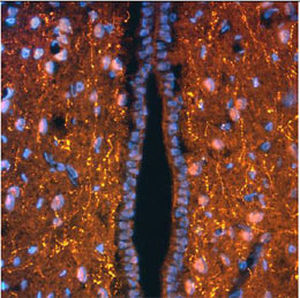
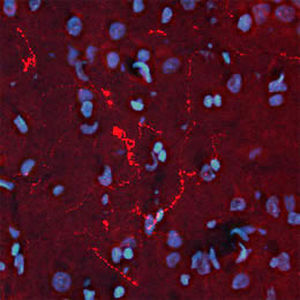
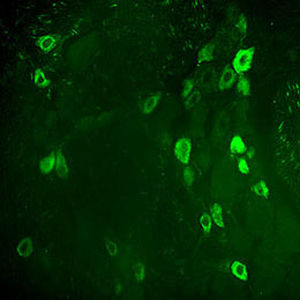
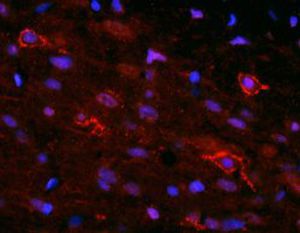
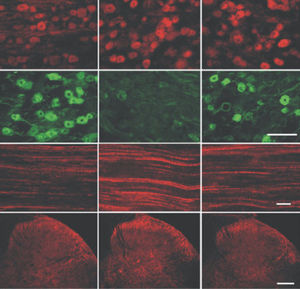
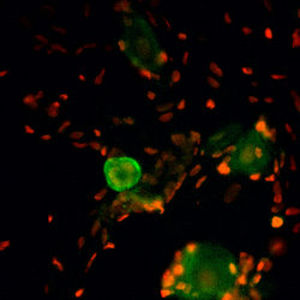
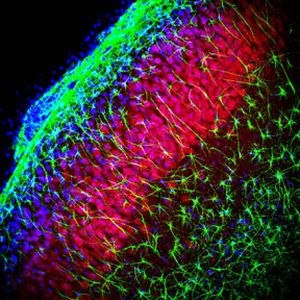
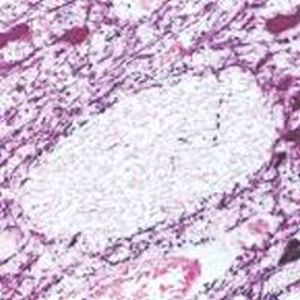
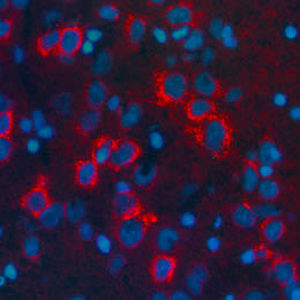
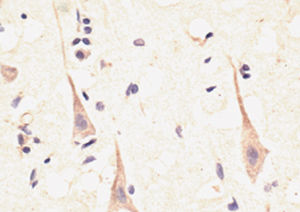
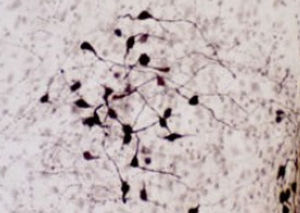
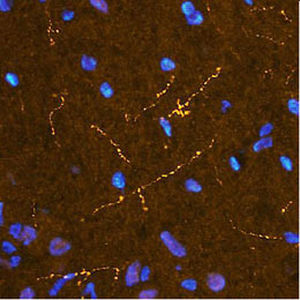
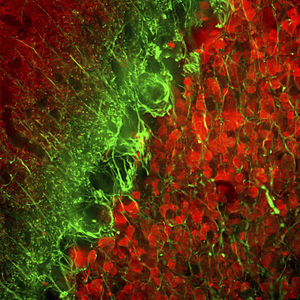
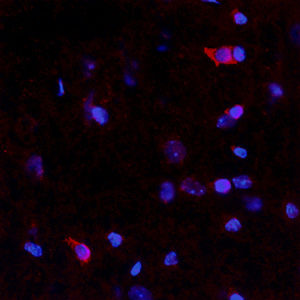
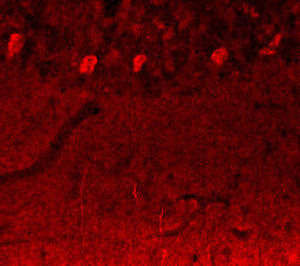
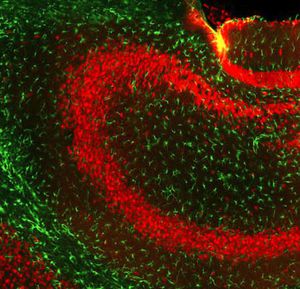
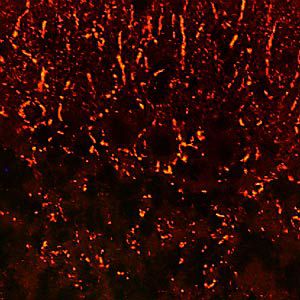
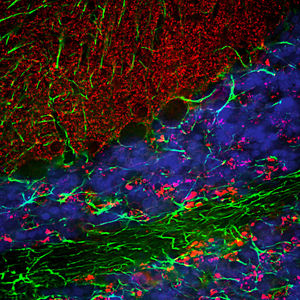
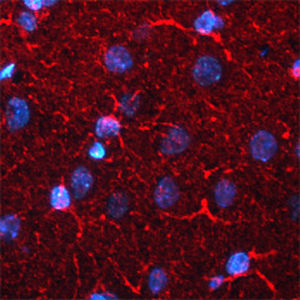
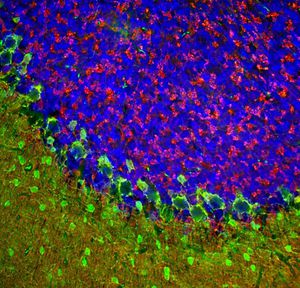
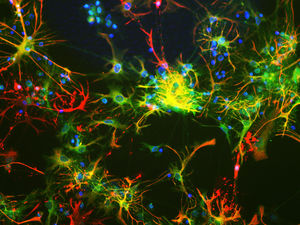
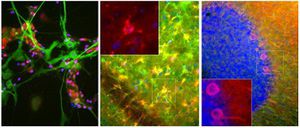
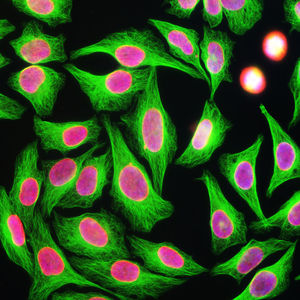
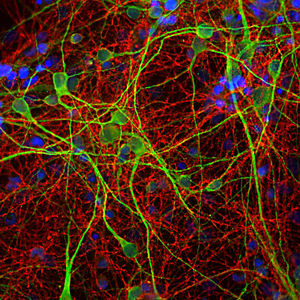
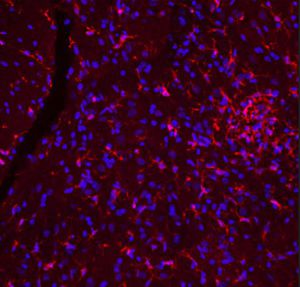
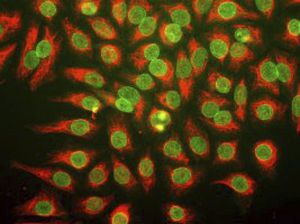
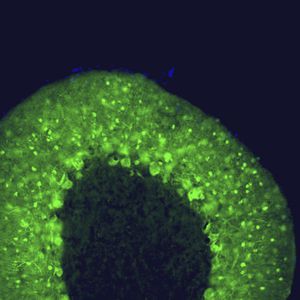
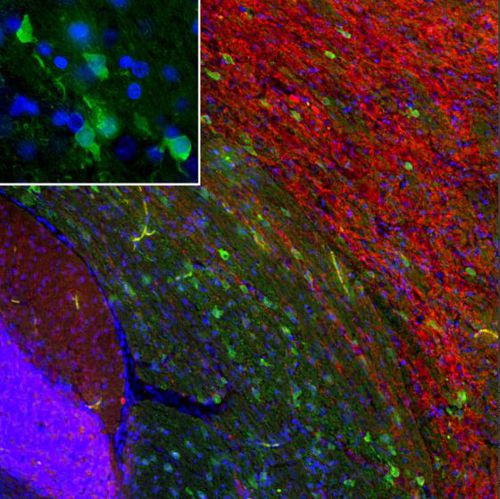
PEA-15 wurde ursprünglich als ein Hauptprotein mit niedrigem Molekulargewicht aus embryonalen striatalen Astrozyten der Maus isoliert, die in Zellkultur gezüchtet wurden. Drei Flecken auf 2D-Gelen mit einem scheinbaren Molekulargewicht von 15 kDa und einem isoelektrischen Punkt von 5,1-5,3 erwiesen sich als verschiedene Formen eines Proteins. Das Protein wurde sowohl in vivo als auch in vitro an einer Stelle durch die Proteinkinase C serinphosphoryliert und erhielt den Namen "phosphoprotein enriched in astrocytes of 15kDa", also PEA-15. Die anschließende Klonierung und Sequenzierung ergab ein Protein, das in seiner Sequenz zwischen Maus und Mensch gut konserviert ist und im Gehirn stark exprimiert wird. Unabhängig davon wurde festgestellt, dass dasselbe Protein in Fibroblasten und Geweben von Diabetikern vermehrt vorkommt, weshalb es als "protein enriched in diabetes" oder PED bezeichnet wurde. Immunzytochemische Untersuchungen zeigten, dass das Protein in Astrozyten und bestimmten Neuronen im ZNS von Mäusen stark exprimiert wird, obwohl es ubiquitär in geringerem Umfang exprimiert wird. Es wurde gezeigt, dass PEA-15 mit der extrazellulären signalregulierten Kinase interagiert und den Eintritt dieses Proteins in den Zellkern reguliert, und es wurden mehrere andere wichtige Interaktionen mit anderen Proteinen beschrieben, die an der Regulierung von Apoptose, Glukosestoffwechsel und Zellwachstum beteiligt sind. MCA-4D2 wurde gegen ein rekombinantes PEA-15-Konstrukt in voller Länge hergestellt, das in E. coli exprimiert und gereinigt wurde.
---
Kataloge
Für dieses Produkt ist kein Katalog verfügbar.
Alle Kataloge von Neuromics anzeigenVerwandte Suchbegriffe
- Reagenzkit
- Reagenzkit für Molekularbiologie
- Flüssiges Reagenzkit
- Reagenzkit für Forschungszwecke
- Analysesoftware
- Protein-Reagenzkit
- Reagenz für die Immunologie
- Antikörper
- Laborsoftware
- Gefriergetrocknetes Reagenzkit
- Serum-Reagenzkit
- Immunohistochimie-Reagenzkit
- Reagenzkit für Enzyme
- Reagenzkit / monoklonaler Antikörper
- Reagenzkit für Western Blot
- Reagenz für wissenschaftliche Forschung
- Software für Forschungszwecke
- Reagenzkit für Immunofluoreszenz
- Reagenzkit / polyklonaler Antikörper
- Zytokin Reagenzkit
* Die Preise verstehen sich ohne MwSt., Versandkosten und Zollgebühren. Eventuelle Zusatzkosten für Installation oder Inbetriebnahme sind nicht enthalten. Es handelt sich um unverbindliche Preisangaben, die je nach Land, Kurs der Rohstoffe und Wechselkurs schwanken können.