- Labor
- Labormedizin
- K-Proteinase-Reagenz
- Guangzhou Dongsheng Biotech Co., Ltd.

- Produkte
- Kataloge
- News & Trends
- Messen
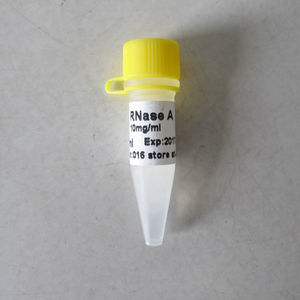
Enzyme-Reagenz N9012ProteaseK-Proteinasefür Molekularbiologie
Zu meinen Favoriten hinzufügen
Zum Produktvergleich hinzufügen
Eigenschaften
- Typ
- Enzyme, Protease, K-Proteinase
- Anwendung
- für Molekularbiologie
- Getesteter Marker
- Hämoglobin, Phosphat, genomische DNA, Kalium, Harnstoff
- Weitere Eigenschaften
- analysiert
- Lagertemperatur
-20 °C, 4 °C
(-4 °F, 39 °F)
Beschreibung
Proteinase K ist eine endolytic Protease, die Peptidbindungen an den karboxylhaltigen Seiten von aliphatischen, aromatischen oder hydrophoben Aminosäuren zerspaltet. Die Proteinase K wird als Serinprotease klassifiziert. Das kleinste durch dieses Enzym hydrolysiert zu werden Peptid, ist ein Tetrapeptid.
Eigenschaften
• Gebrauchsfertige Lösung
• Recombinant Proteinase K
• Aktiv in einer breiten Palette von Reaktionsprodukten
Anwendungen
• Isolierung genomischer DNA von kultivierten Zellen und von den Geweben
• Abbau von DNAsen und von RNases, wenn DNA und RNS von den Geweben oder von den Zellformen lokalisiert werden
• Bestimmung der Enzymlokolisierung
• Verbessern von Klonen-Leistungsfähigkeit von PCR-Produkten
Qualitätskontrolle
DNAse-Tätigkeit: Kein nachweisbare Enzymaktivität nach 6 Stunden Ausbrütung mit λ DNA an 37ºC.
RNase-Tätigkeit: Kein nachweisbare Ribonucleasetätigkeit nach 16 Stunden Ausbrütung mit RNS an 25ºC.
Quelle
Von den Hefezellen mit dem geklonten Gen, das genetisch verschlüsselt, führte endolytic Protease Engyodontium-Albums (Tritirachium-Album) aus.
Molekulargewicht
kDa 29,3 Monomere.
Definition der Tätigkeits-Einheit
Eine Einheit des Enzyms befreit Folin-positive Aminosäuren und Peptide entsprechend 1 µmol Tyrosin in 1 Minute an 37°C, pH 7,5 unter Verwendung des denaturierten Hämoglobins als Substrat.
Enzymaktivität wird in der folgenden Mischung geprüft: 0,08 m-Kaliumphosphat (pH 7,5), 5 m-Harnstoff, 4 Millimeter NaCl, 3 Millimeter CaCl2 und 16,7 mg/ml Hämoglobin.
Speicherpuffer
Das Enzym wird herein geliefert: 50 Millimeter Tris-HCl (pH 7,5), Ca2+ und Glyzerin als Stabilisatoren enthalten.
Weitere Produkte von Guangzhou Dongsheng Biotech Co., Ltd.
In-Vitrodiagnoseprodukte
Verwandte Suchbegriffe
- Reagenzkit
- Reagenzkit / als Lösung
- Reagenzkit für Molekularbiologie
- Flüssiges Reagenzkit
- Reagenzkit für Forschungszwecke
- Protein-Reagenzkit
- Diagnose-Reagenzkit
- Labor-Reagenzkit
- Enzyme-Reagenzkit
- Reagenzkit für die Histologie
- Reagenzkit / reaktives Milieu
- Farbstoff Reagenzkit
- Pufferlösungs-Reagenzkit
- Reagenzkit für PCR
- Viren-Reagenzkit
- Gewebe-Reagenzkit
- Gefriergetrocknetes Reagenzkit
- Nukleinsäure-Reagenzkit
- Reagenzkit für DNA-Extraktion
- Elektrolyten-Reagenzkit
* Die Preise verstehen sich ohne MwSt., Versandkosten und Zollgebühren. Eventuelle Zusatzkosten für Installation oder Inbetriebnahme sind nicht enthalten. Es handelt sich um unverbindliche Preisangaben, die je nach Land, Kurs der Rohstoffe und Wechselkurs schwanken können.