- Labor
- Labormedizin
- Färbelösungs-Reagenz
- Celnovte Biotechnology Co., Ltd.
Reagenz / Immunglobulinklasse G CIM-0120FärbelösungAntikörperFarbstoff
Zu meinen Favoriten hinzufügen
Zum Produktvergleich hinzufügen
Eigenschaften
- Typ
- Färbelösung, Antikörper, Farbstoff
- Anwendung
- für Zytologie, Immunohistochimie
- Format
- flüssig
- Getesteter Marker
- Protein, Immunglobulinklasse G
- Methode
- immunologisch
- Herkunft
- tierische Herkunft
- Weitere Eigenschaften
- hochempfindliche
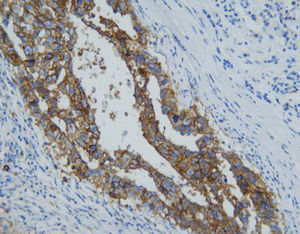
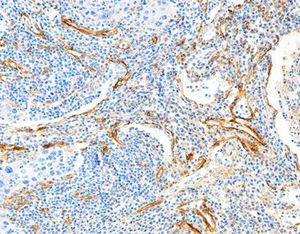
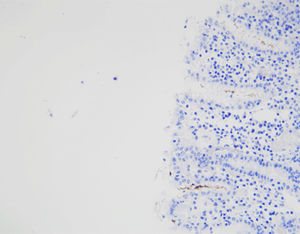
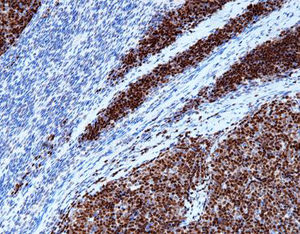
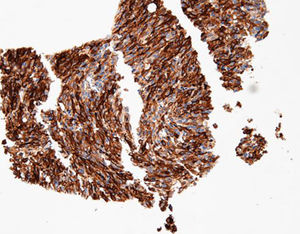
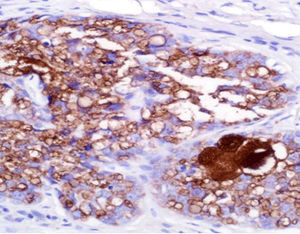
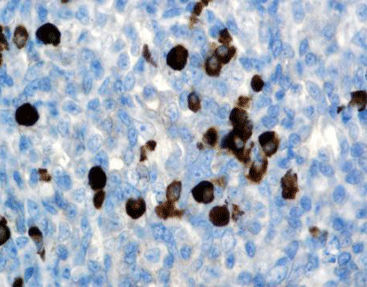
Beschreibung
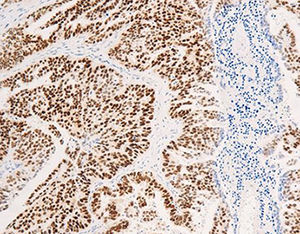
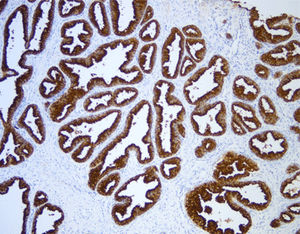
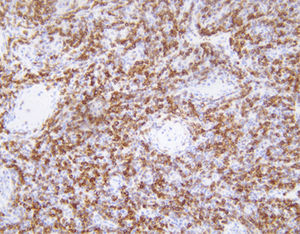
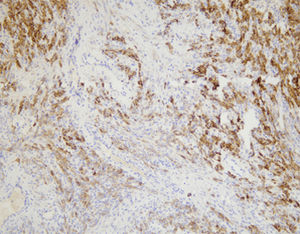
Das menschliche Immunprotein besteht aus zwei identischen schweren Ketten (ca. 50kD) und zwei identischen leichten Ketten, die durch eine Disulfur-Bindung verbunden sind; die leichten Ketten sind κ oder λ. Die schweren Ketten der fünf Immunglobuline IgA, IgD, IgE, IgG und IgM sind unterschiedlich. IgA und IgM unterscheiden sich, weil sie Polypolymere bilden können, die schwere Kette von IgG ist eine γ-Kette.Das menschliche IgG besteht aus vier Unterklassen mit nur geringfügig unterschiedlichen Aminosäuren. IgG-Antikörper werden Berichten zufolge verwendet, um die Klassifizierung von IgG-haltigen Plasmazellen, Lymphozyten und von B-Zellen abgeleiteten Tumoren zu ermitteln. Die normale B-Zell-Population ist polyklonal und exprimiert eine Reihe verschiedener Immunglobuline. Im Gegensatz dazu sind die meisten B-Zell-Tumoren durch eine monoklonale Zellproliferation gekennzeichnet, die eine leichte Kette exprimiert, während dieselbe Zelle mehr als eine schwere Kette exprimieren kann.Zu den IgG-positiven Tumoren gehören Haarzellenleukämie, Milz-Lymphom und Follikel-Lymphom.
---
Kataloge
Für dieses Produkt ist kein Katalog verfügbar.
Alle Kataloge von Celnovte Biotechnology Co., Ltd. anzeigenWeitere Produkte von Celnovte Biotechnology Co., Ltd.
PRIMARY ANTIBODY
Verwandte Suchbegriffe
- Reagenzkit
- Testkit
- Reagenzkit / als Lösung
- Blut-Testkit
- Reagenzkit für Molekularbiologie
- Immunoassay-Testkit
- Flüssiges Reagenzkit
- Testkit für Infektionskrankheiten
- Reagenzkit für Forschungszwecke
- Diagnose-Reagenzkit
- Protein-Reagenzkit
- Labor-Reagenzkit
- Enzyme-Reagenzkit
- Molekularer Testkit
- Reagenzkit für die Histologie
- Testkit für Kliniken
- Reagenzkit / reaktives Milieu
- Reagenz für die Immunologie
- Reagenzkit für Zytologie
- Antikörper
* Die Preise verstehen sich ohne MwSt., Versandkosten und Zollgebühren. Eventuelle Zusatzkosten für Installation oder Inbetriebnahme sind nicht enthalten. Es handelt sich um unverbindliche Preisangaben, die je nach Land, Kurs der Rohstoffe und Wechselkurs schwanken können.